 Chlamydophila pneumoniae (C. pneumoniae) est une bactérie le plus largement connu comme un agent pathogène respiratoire humain, mais elle a récemment été étudié pour son rôle dans l’athérosclérose: une maladie inflammatoire artérielle systémique chronique causée par l’accumulation de matières grasses. L’implication de C. pneumoniae dans l’athérosclérose a été étudié par des études séro-épidémiologiques, des études histopathologiques, et dans des modèles animaux. Les mécanismes par lesquels C. pneumoniae peuvent modifier les propriétés de la paroi cardio-vasculaire peut comprendre le rôle des bactéries dans la formation des cellules spumeuses (lésions athérosclérotiques précoces), et sa capacité à induire des facteurs de croissance et cytokines pro-inflammatoires. Les études sur les vaccins possibles contre ces bactéries sont en cours.
Chlamydophila pneumoniae (C. pneumoniae) est une bactérie le plus largement connu comme un agent pathogène respiratoire humain, mais elle a récemment été étudié pour son rôle dans l’athérosclérose: une maladie inflammatoire artérielle systémique chronique causée par l’accumulation de matières grasses. L’implication de C. pneumoniae dans l’athérosclérose a été étudié par des études séro-épidémiologiques, des études histopathologiques, et dans des modèles animaux. Les mécanismes par lesquels C. pneumoniae peuvent modifier les propriétés de la paroi cardio-vasculaire peut comprendre le rôle des bactéries dans la formation des cellules spumeuses (lésions athérosclérotiques précoces), et sa capacité à induire des facteurs de croissance et cytokines pro-inflammatoires. Les études sur les vaccins possibles contre ces bactéries sont en cours.
il genre Chlamydia est composé de petites bactéries intracellulaires Gram négatif qui dépendent de leur hôte pour la croissance et la survie. C. pneumoniae est soumis à un cycle de développement unique, à deux phases constitué par deux formes morphologiquement et fonctionnellement distinctes: le corps élémentaires (EB) et le corps réticulaire (RB). L’EB est parfois appelée la forme de survie, car il a la capacité de survivre à l’extérieur des cellules humaines (Figure 2F). Une fois que les conditions sont favorables, la fixation se produit (figure 2A) et RB sont formés à l’intérieur de l’hôte où ils se divisent activement (figure 2B, C, D). Le RB reproduit et forme un microcolonies intérieur de la cellule, puis différencie à nouveau de nouveau dans sa forme EB (Figure 2F), qui est ensuite libéré de la cellule infectée pour commencer le cycle suivant. Dans certaines conditions, les RBs ne font pas de nouveau dans EB, mais forment «corps d’inclusion» (figure 1, partie 3) qui ne se réplique pas et permettent à la bactérie de maintenir une infection latente chronique (Parc 2010). La figure 2 montre ce cycle de vie biphasique avec les deux EbS et RB. Contrairement à d’autres agents pathogènes véhiculés par Chlamydia humaines telles que C. trachomatis, C. pneumoniae peut infecter et de survivre dans une grande variété de types de cellules hôtes telles que les macrophages résidents, l’épithélium du poumon, des cellules des muscles lisses artériels, les monocytes circulants et l’endothélium vasculaire (BELLAND 2004).
Récemment, C. pneumoniae a été étudié pour ses implications dans l’apparition ou la progression de plusieurs maladies non pulmonaire telles que l’athérosclérose. Ce développement de la recherche a été déclenchée lorsque les enquêteurs ont commencé à chercher d’autres bactéries telles que Helicobacter pylori au début des années 1990 (Campbell, 1998). Ces études ont conclu que la liaison entre l’infection et de l’athérosclérose est beaucoup plus forte pour C. pneumoniae que pour Helicobacter pylori ou d’autres bactéries (Campbell, 1998). Fait intéressant, un grand nombre d’études ont signalé une association entre C. pneumoniae et des symptômes de l’athérosclérose, tels que la sténose de l’artère carotide (rétrécissement ou étranglement de la surface interne de l’artère carotide), une maladie des artères coronaires (CAD) (accumulation de plaque à l’intérieur coronaire artères), et les extrémités inférieures obstruction de l’artère (plaque artérielle accumulation dans les hanches, les jambes et les mollets) (Brykczynski 2012).
athérosclérose
Une plaque d’athérome montrant le lipide riche noyau central nécrotique, la capsule fibreuse, et les médias d’amincissement sur toute la circonférence. Permission accordée par le Dr Ronald A. Delellis, L’École de médecine Warren Alpert de l’Université Brown. Source: http://www.brown.edu/Courses/Digital_Path/systemic_path/cardio/atherosclerosis-ca.html
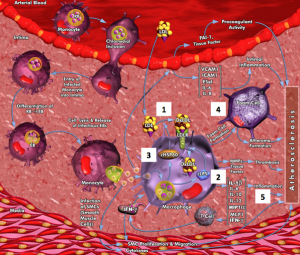
Les maladies cardiovasculaires (MCV) est l’un des principaux problèmes de santé dans les deux pays développés et en développement (Watson 2008). Les manifestations cliniques de CVD comprennent le syndrome coronarien aigu (aucun des symptômes attribués à l’obstruction des artères coronaires), accident vasculaire cérébral (perte rapide de la fonction cérébrale due à une perturbation de l’approvisionnement en sang au cerveau), et l’angine de poitrine (douleur thoracique due à une obstruction des artères coronaires) . Le processus pathologique principale menant à ces événements cardiovasculaires est l’athérosclérose (l’accumulation de matières grasses menant à l’artère épaississement de la paroi) (Watson 2008). Les lésions d’athérosclérose se produisent principalement dans les artères élastiques (grandes) et musculaires (petites) et se composent de trois éléments distincts: 1) l’athérome (matériau jaunâtre au centre composé de macrophages);les cristaux de cholestérol sous-jacents et; 3) la calcification de la base externe de lésions avancées ou plus âgés (figure 3). (Ross, 1999). les dépôts de calcium peut être vu à la gauche de la plaque. L’ensemble de la plaque est recouverte par un capuchon fibromusculaire.
L’athérosclérose est une maladie qui se développe généralement plusieurs années avant que les symptômes eux-mêmes (Ross, 1999) manifestent. Lorsque lipoprotéines (LDL) des dépôts à faible densité deviennent oxydée (oxLDL) dans la paroi vasculaire du cœur, elle stimule la migration des monocytes dans le compartiment sous-endothélial (Watson 2008). Ces cellules absorbent oxLDL via les récepteurs scavenger (SR) et activés macrophages mousse à cellules deviennent , également connu sous le nom «stries lipidiques»(Watson 2008). Les interactions entre les macrophages et les lymphocytes et les réponses inflammatoires de réparation continuent pendant de nombreuses années en augmentant le volume de la plaque d’athérome. Ces plaques sont constituées d’une capsule fibreuse protégeant la lumière du vaisseau (l’espace ouvert d’un vaisseau sanguin) du noyau lipidique riche en macrophages. Comme l’activité inflammatoire se poursuit à l’intérieur des plaques, elle peut conduire à un affaiblissement de la coiffe, ce qui augmente la probabilité qu’il se rompt, libérant la matière lipidique. Cette matière active les plaquettes, et peut conduire à la formation d’un thrombus (caillot sanguin) ou éventuellement de l’angine de poitrine (douleurs thoraciques cardiaque) ou l’infarctus du myocarde (crise cardiaque).
Association de C. pneumoniae à l’athérosclérose
Il existe des preuves pour suggérer que C. pneumoniae pourrait jouer un rôle dans tous les stades de l’athérosclérose, de la lésion initiale à la rupture de plaque (Kalayoglu 2000). La meilleure preuve pour une association de C. pneumoniae à l’athérosclérose a été démontré par i) des études séro-épidémiologiques; ) des études histopathologiques, et; iii) des modèles animaux. Des études séro-épidémiologiques et études séro-épidémiologiques analysent les niveaux d’un titre d’anticorps spécifique dans un groupe d’individus. Dans les études séro-épidémiologiques suivantes, le nombre d’anticorps spécifiques de C. pneumoniae ont été comparés entre les patients athérosclérotiques et les individus en bonne santé.
Le premier rapport d’une association possible entre l’infection à C. pneumoniae et l’athérosclérose née en 1988 d’une petite étude transversale à Helsinki, qui a montré que les patients atteints de coronaropathie stable chronique ou l’infarctus du myocarde aigu (AMI) étaient significativement plus susceptibles d’avoir augmenté C . pneumoniae anticorps que chez les témoins (50-60% et 7-12%, respectivement) (Saikku 1988). Cela a incité d’autres études pour étudier l’association entre la maladie et l’organisme. Des études de suivi ont confirmé les conclusions d’Helsinki en montrant une association entre les titres d’anticorps élevés et une maladie coronarienne angiographie vérifié (un test qui utilise des colorants et des rayons X pour montrer l’intérieur des artères coronaires) (Thom, 1991). Cependant, ces études transversales sont de mauvais indicateurs de causalité puisque les deux facteurs sont observés en même temps. En outre, la plupart des études séro-épidémiologiques réalisées à ce moment impliqué les populations âgées, ce qui est pas une bonne mesure en raison de la prévalence élevée de C. pneumoniae séropositivité chez ces groupes d’âge (Campbell, 1998). En outre, les populations plus âgées connaissent des stades ultérieurs de la maladie, ce qui rend difficile de déterminer un rôle causal potentiel de C. pneumoniae tôt dans le processus d’athérome (Campbell, 1998). Par conséquent, les études histopathologiques et les études animales sont généralement plus crédible.
Les études histopathologiques regardent l’anatomie microscopique des cellules et des tissus. Les études histopathologiques suivantes ont examiné les cellules et les tissus en sectionnant et coloration, sous une lumière ou au microscope électronique.
Preuve de la présence de C. pneumoniae dans les lésions athéroscléreuses a émergé de plus de 40 études, menées par plusieurs groupes de chercheurs. Les données recueillies à partir de 43 études, publiées avant Octobre 2002 indiquent une forte prévalence de C. pneumoniae (46% des 1852 échantillons) dans le tissu athérome mais pas (<1% de plus de 239 spécimens) dans les artères en bonne santé (Kalayoglu, 2002). Ces études ont porté sur immunohistochimie (IHC), la microscopie électronique (EM), la réaction en chaîne par polymérase (PCR) et la culture cellulaire.
Shor et al. (1992) ont été les premiers à montrer que C. pneumoniae était présent dans les lésions athérosclérotiques confirmées. En utilisant la microscopie électronique à transmission (MET), les chercheurs ont été capables de détecter C. pneumoniae dans des macrophages en cellules spumeuses. Les cellules spumeuses des macrophages sont des macrophages chargés de lipides qui sont entourés d’un corps gras, le plus souvent du cholestérol. Ils se forment lorsque le corps envoie des macrophages à l’endroit d’un dépôt graisseux sur la paroi du vaisseau sanguin. L’une des caractéristiques de l’athérosclérose est la présence de ces cellules. Le fait que la pneumonie C a été trouvée dans ces macrophages gras est un bon indicateur du rôle de la bactérie de la maladie.
Dans une étude ultérieure visant à regarder plus jeunes populations (Kuo, 1995), C. pneumoniae a été trouvé dans les lésions athérosclérotiques dans les tissus d’autopsie provenant des individus âgés entre 15 et 34. Les bactéries a été trouvé dans les cellules de mousse localisées dans la couche profonde de la plaque d’athérome (Kuo, 1995). Les enquêteurs ont pu conclure que C. pneumoniae peut être trouvée dans une forte proportion de lésions de la plaque d’athérome dans les artères coronaires de jeunes individus, ce qui était différent de celui des études histopathologiques précédents et études séro-épidémiologiques qui avaient cherché principalement aux populations âgées (Kuo 1995 ). Une deuxième constatation notable est que dans les tissus sans preuve de l’athérosclérose, aucune C. pneumonie a été trouvé en utilisant les mêmes techniques (Kuo, 1995). Cette constatation est importante, car elle commence à expliquer la causalité plutôt que la corrélation. Constatations de C. pneumonie dans les tissus athérosclérotiques jeunes est plus puissant que dans les tissus de personnes âgées en raison de la prévalence déjà élevée des bactéries dans une grande partie de la population. Par conséquent, étant présent dans les tissus arthérioscléreuse et non dans le tissu sain des jeunes patients prédit un rôle causal.
Bien que la présence de bactéries dans le tissu infecté est particulièrement importante, des études supplémentaires ont montré que C. pneumoniae est sensiblement absent du tissu non malade ou un tissu non lié au site de la maladie (poumon, du foie, de la rate, la moelle osseuse et les tissus des ganglions lymphatiques ) (Jackson, 1997). C. pneumoniae a été détectée dans aucun des artères normales apparaissant coronaires, 33% des artères avec un épaississement de l’intima ou au début des plaques, et 38% des artères avec plaque de pointe (Jackson, 1997). Sur les 21 échantillons testés positifs pour C. pneumoniae, 11 seulement ont été testés positifs pour les tissus cardiovasculaires, 6 ont été testés positifs à la fois dans les tissus cardiovasculaire, et 3 ont été testés positifs au niveau des tissus non cardio-vasculaire (Jackson, 1997). Cette enquête a montré que C. pneumoniae est préférentiellement localisée au niveau du tissu cardiovasculaire, en ajoutant des preuves à l’appui de l’hypothèse que C. pneumoniae peut jouer un rôle dans la pathogenèse de l’athérosclérose.
Etude Animal
L’antigène Chlamydia détectée dans les sections aortiques de souris nourris avec un régime alimentaire normale.La plupart des chercheurs utilisant des modèles animaux, ont introduit l’agent pathogène dans les voies respiratoires (pour simuler le portail d’entrée de l’infection humaine), puis nous examinons le tissu vasculaire pour l’athérosclérose et la présence de l’agent pathogène. De Kruif et ses collègues ont constaté que C. pneumonie diffuse à vascularisation dans de multiples organes. Cette présence de la bactérie dans les poumons et la rate, après inoculation intranasale, a fourni la première preuve expérimentale que C. pneumonie est capable de se diffuser par l’intermédiaire de la circulation sanguine dans tout le corps (De Kruif 2005). Ces résultats suggèrent que C. pneumoniae présente un tropisme pour les tissus vasculaires et peut accélérer le développement de la maladie chez les animaux hyperlipidémiques.
Des études qui cherchent à identifier les mécanismes par lesquels C. pneumoniae peut modifier les propriétés de la paroi du vaisseau sont en cours. Les données issues de ces expériences in vitro se concentrent sur la réponse de la cellule hôte à l’infection et ont identifié plusieurs voies qui sont activées dans l’athérogenèse. Par exemple, C. lipopolysaccharide pneumoniae a été montré in vitro pour favoriser la formation de cellules spumeuses dans les macrophages exposée à oxyder la lipoprotéine de basse densité (LDL) (Kalayoglu 1999, Kalayoglu 2000). Un autre composant C. pneumoniae, Chlamydia protéine de choc thermique 60, a été montré pour favoriser l’oxydation des LDL à sa forme proathérogène et stimuler la synthèse de métalloprotéinases de la matrice dans les macrophages (Kol 1998).
En plus de la formation des cellules spumeuses et l’oxydation des LDL, des études ont été faites sur le rôle de C. pneumoniae et l’activation de cytokines et de facteurs de croissance. L’organisme a été montré pour induire la production de cytokines pro-inflammatoires, en fournissant encore un autre mécanisme pour lequel une plaque d’athérosclérose pourrait se développer.
Les modèles animaux testés impliqués souris hyperlipidémiques génétiquement induites, les souris hyperlipidémiques induite par l’alimentation et le cholestérol donné aux lapins de Nouvelle-Zélande. Dans chacun de ces trois modèles, une infection à C. répétée pneumonie a été montré pour accélérer le développement de la plaque. Une autre provient d’une étude réalisée avec des souris hyperlipidémiques induite par l’alimentation. Dans certaines parties les souris ont été traitées avec un régime riche en cholestérol, plus l’infection par C. pneumoniae, l’antigène LPS chlamydia a été détecté dans l’aorte (Hu 1999). En revanche, l’antigène LPS n’a pas été détecté chez les souris qui ne recevaient pas une infection à Chlamydia (Hu, 1999). Fait intéressant, aucun antigène Chlamydia évidente a été détectée dans des coupes aortiques de souris nourries avec un « chow » normal de souris et infecté par C. pneumonie (Hu 1999). Les images prises à un objectif de puissance plus élevée en outre révélé corps comme l’inclusion des structures chlamydia (Hu 1999). Ceci suggère que C. pneumonie est un facteur co-risque avec hyperlipidémie et que les effets athérogènes de C. pneumonies sont subordonnées à la réponse du corps à l’hyperlipidémie (Watson 2008). Dans tous ces modèles animaux, C. pneumonie a été identifiée dans les cellules de la mousse ou aux sites d’inflammation (Hu, 1999).
Fait intéressant, d’autres agents pathogènes comme la pneumonie mycoplasme, Helicobacter pylori et Chlamydia trachomatis ont été trouvées pour ne pas induire des changements d’athérome (Sessa 2009). Pris ensemble, on peut déduire que C. pneumoniae a une affinité pour le système vasculaire où elle peut induire une inflammation et peut initier ou favoriser le développement des lésions d’athérosclérose chez des souris (Kalayoglu 2002).
Des études qui cherchent à identifier les mécanismes par lesquels C. pneumoniae peut modifier les propriétés de la paroi du vaisseau sont en cours. Les données issues de ces expériences in vitro se concentrent sur la réponse de la cellule hôte à l’infection et ont identifié plusieurs voies qui sont activées dans l’athérogenèse. Par exemple, C. lipopolysaccharide pneumoniae a été montré in vitro pour favoriser la formation de cellules spumeuses dans les macrophages exposée à oxyder la lipoprotéine de basse densité (LDL) (Kalayoglu 1999, Kalayoglu 2000). Un autre composant C. pneumoniae, Chlamydia protéine de choc thermique 60 , a été montré pour favoriser l’oxydation des LDL à sa forme proathérogène et stimuler la synthèse de métalloprotéinases de la matrice dans les macrophages (Kol 1998).
En plus de la formation des cellules spumeuses et l’oxydation des LDL, des études ont été faites sur le rôle de C. pneumoniae et l’activation de cytokines et de facteurs de croissance. L’organisme a été montré pour induire la production de cytokines pro-inflammatoires, en fournissant encore un autre mécanisme pour lequel une plaque d’athérosclérose pourrait se développer.
En raison de la prévalence élevée de C. pneumoniae, la découverte d’un vaccin efficace aurait des avantages à grande échelle pour la santé humaine. Cependant, bien que des progrès considérables dans le développement d’un vaccin a été fait au cours des dix dernières années, aucun n’a offert une immunité de longue durée chez les humains. Le principal défi a été de trouver un vaccin pour conférer une immunité plus forte contre l’infection naturelle, étant donné que la réinfection est si fréquent chez les humains (Watson 2008).
Certaines études ont testé l’effet des antibiotiques dans le traitement de l’athérogenèse base expérimentale chez des souris et des lapins infectés par Chlamydia. Il a été rapporté que l’azithromycine a empêché l’athérosclérose accélérée chez les lapins hyperlipidémiques infectés par C. pneumonie, mais n’a pas éradiquer les bactéries (Rothstein, 2001).
Des études depuis ont mis l’accent sur l’attaque des protéines cytoplasmiques ou des protéines de la membrane externe caractéristiques du genre chlamydia (Penttilä 2000, Thorpe, 2007). Penttila et. Al. (2000) a porté sur la protéine majeure de la membrane externe (MOMP), la cystéine-ich protéine de membrane externe 2 (Omp2) et la protéine de choc thermique 60 (Hsp60). Bien que l’immunisation avec pMOMP ou phshp60 a montré réduit IFU compte dans les poumons des souris, il n’a pas offert une protection contre la pneumonie et n’a pas réduit la gravité de histologiquement pneumoniae évalué (Penttila 2000).
En 2007, Thorpe et. Al. fait état d’une étude à l’aide d’un vaccin contre la protéine recombinante qui a induit une réponse immunitaire chez les souris qui étaient capables d’éradiquer l’infection. Les enquêteurs ont examiné la surface exprimée ou sécrétée protéines présentes dans la famille Chlamydia (Thorpe, 2007). Un antigène particulier, appelé LCRE, induite par CD4 + et l’activation des lymphocytes T CD8 + de type I, la sécrétion de cytokines et d’anticorps neutralisants (Figure 9) (Thorpe, 2007). Des anticorps contre OMPH et LCRE réduit de façon significative les titres d’anticorps (figure 9), tandis que les anticorps contre Hypo non. Bien que l’infection a été éradiquée, il est difficile de dire qu’il va faire la même chose chez les humains en raison de la courte durée de vie de l’infection chez les souris. Par conséquent, d’autres études sont nécessaires pour tester ce vaccin.
Conclusion
Il a été démontré son rôle dans l’athérosclérose grâce à des études séro-épidémiologiques, des études histopathologiques, et des études sur des modèles animaux. Des études séro-en épidémiologie ont montré une augmentation des titres d’anticorps chez les patients présentant une maladie coronarienne et d’infarctus du myocarde aigu. Des études histopathologiques ont été en mesure de montrer C. pneumoniae présents dans les lésions athéroscléreuses par PCR, coloration immunocytochimique, et la microscopie électronique. Ces études ont également joué un rôle crucial pour montrer l’absence de l’organisme dans les tissus et les tissus non-athéroscléreux à d’autres sites dans le corps. Des études animales effectuées avec des souris hyperlipidémiques et non, ainsi qu’avec des lapins blancs de Nouvelle-Zélande, ont montré que C. pneumoniae puisse provoquer une athérosclérose lorsque, en présence de taux élevés de cholestérol. Séroépidémiologiques, et des études de modèles animaux histopathologiques continuera comme plus de la physiopathologie de C. pneumoniae dans l’athérosclérose est découvert.
Bien que la pathogenèse de C. pneumoniae est encore à l’étude..Il a été réalisés au cours des dernières années avec la découverte de différents facteurs qui peuvent contribuer au développement des plaques d’arthérosclérose. Les résultats impliquant cLPS, cHSP60, et leur rôle dans l’oxydation des LDL et la formation des cellules de mousse sont remarquables.
La conclusion selon laquelle cLPS était suffisante pour induire l’absorption de LDL-Dil en macrophages était important pour le mécanisme de formation des cellules spumeuses. CHSP60 a été trouvée pour induire l’oxydation des LDL de monocytes ainsi que activer les cellules vasculaires humaines, ce qui suggère un mécanisme d’inflammation. l’analyse des puces à ADN a été crucial dans la recherche que les cellules endothéliales infectées par C. pneumoniae ont des gènes régulés à la hausse codant pour des facteurs inflammatoires. Bien qu’il soit probable que les voies de signalisation pour cLPS et cHSP60 chevauchement depuis les activités cellulaires similaires sont invoquées par les deux composants, des expériences futures plonger plus loin dans la compréhension de la façon dont ces facteurs favorisent les événements arthérogènes tels que la formation des cellules de la mousse et l’oxydation des LDL.
L’idée que C. pneumoniae est impliqué dans l’athérosclérose est difficile à prouver. Parce que la pathogenèse est extrêmement compliquée, aucune expérience unique sera prouver ou de réfuter l’idée. L’accumulation de plus de preuves va batir les connaissances sur le rôle de la bactérie dans la maladie. Dans l’avenir, des études mieux définies sur la pathogenèse bactérienne va ajouter à cet ensemble de preuves. Identifier et tester des stratégies immunologiques ou thérapeutiques qui éradiquent les bactéries dans les deux régions respiratoires et cardiovasculaires peuvent être conduire à la réponse finale.
Source : https://microbewiki.kenyon.edu/index.php/Chlamydophila_pneumoniae_in_Atherosclerosis
https://www.qiagen.com/fr/shop/genes-and-pathways/pathway-details.aspx?pwid=71

Commentaires récents